Звичайний синтез звичайного алмаза
 Завантажити (104 Кб)
Завантажити (104 Кб)
Звичайний синтез звичайного алмаза
Член-кореспондент АН СРСР Б. В. Дерягин, доктор хімічних наук Д. В. Федосєєв
Хімія і життя №10, 1982 р с. 26-29
Майже 200 років тому було встановлено, що алмаз являє собою чистий вуглець, і з тих пір не припинялися спроби отримати цей дорогоцінний камінь штучним шляхом. Історія цих досліджень не менш захоплива, ніж історія алхімічних спроб отримати золото з неблагородних металів; відмінність полягала лише в тому, що, як ми тепер знаємо, синтез алмазу з графіту теоретично можливий, і слід було лише знайти умови, при яких він здійснимо практично. Реалізувати цю ідею вдалося лише в середині нинішнього століття: метаморфоза відбувається при жахливому тиску 100 кілобар і температурі понад 3000 К.
Але навіщо потрібні такі великі тиск і температура і чи не можна отримувати алмази в більш м'яких умовах?
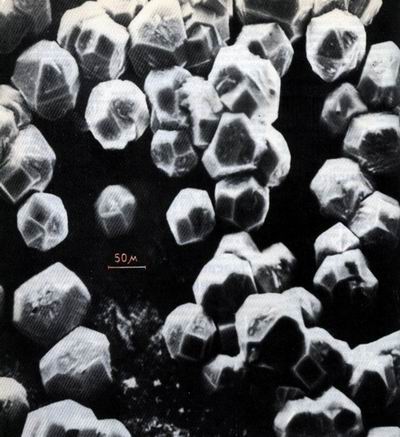
Ограновані кристали алмазу, які виросли на поверхні золота з газової фази
ТЕРМОДИНАМІКА І КІНЕТИКА
При звичайних умовах алмази здаються нам вічними і незмінними. Але ж насправді алмаз являє собою досить нестійку модифікацію вуглецю і при підвищенні температури здатний мимовільно перетворюватися в графіт.
Який зміст вкладаємо ми в слова "нестійка модифікація", "мимовільне перетворення"? Чому таке перетворення йде лише при підвищеній температурі? І чому зворотний процес перетворення графіту в алмаз спостерігається лише при величезному тиску?
На ці питання відповідають термодинаміка - наука, що досліджує рівноважні системи, - і кінетика, наука про швидкості хімічних перетворень.
Уявіть собі засніжений гірський схил, по якому ковзають лижники. Вниз вони ковзають мимовільно, але от щоб забратися знову наверх, їм потрібно затратити чимало праці. Чим вище гора, тим важче лижнику на неї піднятися і тим менше знаходиться диваків, готових витрачати все більше і більше сил. Мабуть, рано чи пізно настане момент, коли всі лижники залишаться внизу, і забава припиниться. Саме в цьому сенсі ми і говоримо про термодинамічної стійкості або нестійкості того чи іншого стану: чим більше енергії потрібно затратити, щоб його досягти, тим цей стан виявляється менш імовірним. Так ось, при низькому тиску стійкою модифікацією вуглецю виявляється графіт, і лише при тиску 100 кілобар рівновагу виявляється помітно зміщеним в сторону алмаза, що показав в 1939 році О. І. Лейпунський.
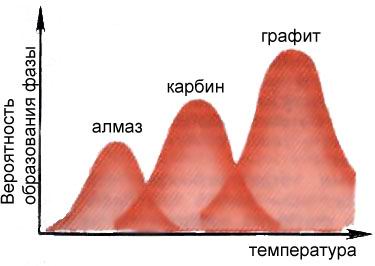
При постійному тиску максимуми ймовірностей освіти різних фаз вуглецю припадають на різні температури, що дозволяє управляти процесом
Продовжимо нашу аналогію. Ускладнимо лижну трасу: зведемо на вершині гори, прямо перед самим початком спуску, бар'єр. Зрозуміло, чим вище це додаткова перешкода, тим важче буде лижникам спуститися вниз, тим більше їм потрібно витрачати додаткову енергію. І якщо цей бар'єр дуже високий, то все піднявшись на вершину лижники вже не зможуть спуститися вниз, хоча термодинамічно такий стан системи і виявиться вкрай нестійким. Саме такий кінетичний бар'єр заважає алмазу, нестійкого термодинамічно при низькому тиску, мимовільно перетворитися на графіт. Але нагрівання повідомляє системі додаткову енергію, за її рахунок бар'єр долається, і система, як і раніше, переходить в термодинамічно стійку модифікацію. І навпаки: при високому тиску, коли стійкий алмаз, підвищення температури сприяє прискоренню процесу, який при низькій температурі протікає з незначною швидкістю.
З цього випливає важливий висновок: при бажанні систему можна перевести в термодинамічно нестійкий стан, як би звівши високий бар'єр на схилі, але спорудивши фунікулер.
Стосовно до алмазу це означає, що ніякого принципового заборони на його синтез при низькому тиску немає: просто потрібно знайти умови, при яких цей процес виявляється більш імовірним, ніж процес освіти графіту, щоб виникли частки алмаза не перетворювалися відразу в графіт і щоб неминуче утворюється графіт не заважав подальшого зростання алмазу.
СТРУКТУРА ПО НАСЛЕДСТВУ
Перших успіхів в цьому напрямку вдалося добитися, використовуючи метод так званої епітаксії - нарощування поверхні вже готового алмазного кристала атомами вуглецю, що утворюються в результаті термічного розкладання газоподібних вуглеводнів на кшталт метану або ацетилену. В цьому випадку поверхню кристала служить як би матрицею, на якій під дією поверхневих сил штампуються такі ж кристалічні шари. Можна сказати, що епітаксіальний синтез полягає як би в спадкуванні брали в облогу шарами первісної структури підкладки.
Епітаксиальні синтез алмазу (точніше, автоепітаксійних, оскільки в цьому випадку алмаз зростає на алмазі) вдалося здійснити, використовуючи як великі монокристали алмазу, так і алмазний порошок. В останньому випадку явище особливо наочно: оскільки алмазний порошок володіє великою питомою поверхнею (до 10 м2 / г), за кінетикою процесу можна спостерігати, просто зважуючи час від часу зразок - швидкість збільшення його маси характеризує швидкість осадження алмаза на мікрокристалах.

Структура зростаючої алмазної плівки
Природно, що осадження алмазної модифікації вуглецю супроводжує засудження графіту; коли ж поверхню алмазної підкладки повністю Графітізуючі, зростання алмазної плівки припиняється і з газової фази продовжує виділятися тільки графіт. Роль, яку відіграє структура алмазної підкладки, продемонстрували досліди, коли в ній навмисно (за допомогою g -опромінення) створювалися мікроскопічні дефекти: в цьому випадку графітизація поверхні помітно прискорювався і знову сповільнювалася після заліковування радіаційних дефектів шляхом відпалу.
На цьому етапі досліджень вдалося отримати першу інформацію про самому хімічному механізмі зростання алмазу з газоподібних вуглеводнів. Було відмічено, що коли вуглеводень розбавлявся молекулярним воднем, то швидкість його розкладання, як і слід було очікувати, зменшувалася, але при цьому швидкість утворення графіту зменшувалася в кілька разів сильніше, ніж швидкість утворення алмазного шару. Було відомо, що при взаємодії метану СН4 з молекулярним воднем можуть виникати два різновиди частинок - вільні радикали СН 3 · і молекули сполуки СН5. Виявилося, що графіт утворюється при подальшому розпаді радикалів, в алмаз - при розпаді молекул СН5 на поверхні кристала: домішка водню пригнічує народження вільних радикалів, але сприяє появі частинок СН5.
Ще більш цікаві результати дало застосування атомарного водню. Для цього суміш метану або іншого вуглеводню пропускалася через плазму тліючого розряду, а потім прямувала на ту чи іншу поверхню, на якій і виділявся елементарний вуглець. Але виділявся тільки у вигляді алмазу, тому що, як з'ясувалося, частинки графіту легко взаємодіють з атомарним воднем і видаляються із зони реакції.
Ці дослідження, виконані В. П. Варнін, показали також, що атомарний водень дозволяє застосовувати в якості підкладки не тільки алмаз, а й інші матеріали. Так, вдалося отримати алмазні плівки, що покривають поверхню молібдену, ренію, кремнію. Алмазні плівки і навіть ограновані монокристали алмазу були отримані Б. В. Спіциним за допомогою хімічних транспортних реакцій, коли вуглець доставлявся до місця синтезу алмазу у вигляді вуглеводневих радикалів.
В. М. Голянов розробив метод отримання алмазоподібних плівок з потоків нейтральних атомів вуглецю. Цей метод полягає в тому, що між графітовими електродами, поміщеними в середу сильно розрідженого інертного газу, запалюється електричний розряд, і утворюються в результаті распиленш матеріалу електродів нейтральні атоми вуглецю направляються на підкладку, охлаждаемую рідким азотом. Утворені при цьому плівки названі алмазо-подібними тому, що представляють собою аморфну модифікацію алмаза: в цій модифікації зв'язку між атомам "вуглецю мають ту ж довжину, що і в алмазі, але характерний для кристала строгий геометричний порядок розміщення атомів відсутня. В той же час по багатьох важливих властивостей алмазоподібні плівки дуже схожі на алмазні.
Нарешті, не можна не згадати про метод отримання алмазних плівок осадженням вуглецю з іонних пучків, розробленому групою співробітників Харківського фізико-технічного інституту. В цьому випадку поведінкою атомів можна керувати за допомогою електричного поля, в результаті чого алмазні покриття вдалося нанести на скло, метали, полімери Тобто в цьому випадку підкладка виявляється просто геометричним місцем зростання алмазу.
Але тоді виникає природне запитання: якщо можна підібрати умови коли структура поверхні, на якій з газової фази зростає алмаз, не має ніякого значення, то чи не можна взагалі відмовитися від підкладки? Іншими словами, чи не можна синтезувати алмаз безпосередньо в газовій фазі?
Алмазна ПИЛ
В "Основах хімії" Д. І. Менделєєва читаємо: "Органічні речовини, що згоряють при недостатньому припливі повітря, виділяють сажу, т. Е. Вугілля, що стався з пароподібні водородістих з'єднань вуглецю, з яких при горінні водень утворює воду". І там же: "Якщо взяти органічна речовина летюча, наприклад, газоподібне з'єднання, що містить вуглець і водень, то вугілля виділяється з такої речовини, якщо пропустити його пар через сильно напружену трубку". Так чому при розпаді вуглеводнів вуглець виділяється у вигляді сажі, а не алмаза?
Всім повинно бути добре відомо явище, коли пересичений розчин миттєво кристалізується після внесення в нього затравки - крихітного кришталика того ж самого речовини. Як і в разі епітаксії, поверхня кришталика служить як би матрицею, на якій відбувається нарощування твердої фази; тільки на відміну від епітаксії кристалізація відбувається спонтанно.
Але запалом може служити не тільки тверда частинка розчиненої речовини; кристалізацію може викликати і будь-яка порошинка, якщо тільки гра випадку створила на її поверхні ділянку, хоч віддалено нагадує структуру кристала. Нарешті, затравочний кристалик може утворитися в пересичені розчині і мимовільно - якщо кілька частинок розчиненої речовини випадково зблизяться в підходящої конфігурації. При розкладанні вуглеводнів спочатку теж утворюється пересичена - тільки газоподібна - фаза вуглецю, і його подальша доля залежить тільки від того, на який зародковий центр він почне осідати. У звичайних умовах найбільш ймовірно мимовільна освіту частинок сажі; але не дорівнює нулю і ймовірність самовільного зародження частинок алмазу. І якщо навчитися керувати процесом утворення зародків, то результатом розкладання вуглеводнів може виявитися алмазний пил - мікроскопічні алмазні частинки.
Спочатку ця ідея здавалася зовсім фантастичною - тим більше, що теоретичний аналіз явища був украй утруднений, а пошук наосліп міг затягтися на багато десятиліть. Проте навіть грубі якісні теоретичні оцінки дали несподіваний результат: виявилося, що повинні існувати умови (відповідні температура і тиск), коли можна очікувати переважного освіти алмазних зародків.
Експериментальні дослідження в цьому напрямку були розпочаті майже одночасно в трьох інститутах: Інституті фізичної хімії АН СРСР, Інституті проблем матеріалознавства АН УРСР, Інституті надтвердих матеріалів АН УРСР. Різні групи дослідників застосовували різні методи розкладання вуглеводнів - лазерний нагрів, електричні розряди, вибух. При цьому для того, щоб запобігти мимовільне перетворення алмаза в графіт, що утворюються частинки алмазного аерозолю доводилося швидко видаляти із зони реакції і охолоджувати, для чого різні дослідники вдавалися до різних хитрощів.
Утворений мікрокристалічний порошок містив практично всі кристалічні модифікації вуглецю: не тільки алмаз, але і графіт, і карбін. Але домішки вдається відокремити від алмазного порошку і отримати в чистому вигляді речовий доказ нашої правоти.
Розроблені методи синтезу алмазу в області його термодинамічної нестабільності мають не тільки величезне наукове значення; вже зараз можна говорити про практичні результати цих досліджень. І справа не в тому, що можна обходитися без величезних тисків, а в тому, що ці методи дозволяють вирішувати унікальні завдання. Так, епітаксіальне осадження може служити методом поліпшення абразивних властивостей алмазних порошків, а також попередньою стадією їх обробки перед спіканням; алмазні плівки перспективні для виготовлення покриттів робочих поверхонь ріжучого інструменту, елементів радіоелектронних пристроїв і контактують пар з малим коефіцієнтом тертя.
Треба сподіватися, що цим методам знайдуться і інші перспективні області застосування.
ЩО ЧИТАТИ Про синтезі АЛМАЗІВ ІЗ ГАЗОВОЇ ФАЗИ
Безруков Г. Н., Бутузов В. П., Самойлович М. І. Синтетичний алмаз. М .: Недра, 1976.
Дерягин Б. В., Федосєєв Д. В. Зростання алмазів і графіту з газової фази. М .: Наука, 1977.
Дерягин Б. В., Федосєєв Д. В. Алмази роблять хіміки. М .: Педагогіка, 1980.
Федосєєв Д. В., Чужко Р. К., Гривцов А. Г. Гетерогенна кристалізація з газової фази. М .: Наука, 1978.
Схожі статті:
1. алмаз Хімічна енциклопедія Т. 1. с. 106
Який зміст вкладаємо ми в слова "нестійка модифікація", "мимовільне перетворення"?
Чому таке перетворення йде лише при підвищеній температурі?
І чому зворотний процес перетворення графіту в алмаз спостерігається лише при величезному тиску?
Іншими словами, чи не можна синтезувати алмаз безпосередньо в газовій фазі?
Так чому при розпаді вуглеводнів вуглець виділяється у вигляді сажі, а не алмаза?